近日,威斯尼斯贵州省常见慢性疾病发病机制及药物研究重点实验室郭兵教授团队在国际权威期刊《Autophagy》(中科院1区Top期刊,IF:13.3)上发表研究论文“TIGAR exacerbates obesity by triggering LRRK2-mediated defectsin macroautophagyandchaperone-mediated autophagyin adipocytes”。该研究揭示TIGAR通过LRRK2-RAB7B复合体抑制自噬加重肥胖的病理新机制,为治疗肥胖提供了一种新的可能。

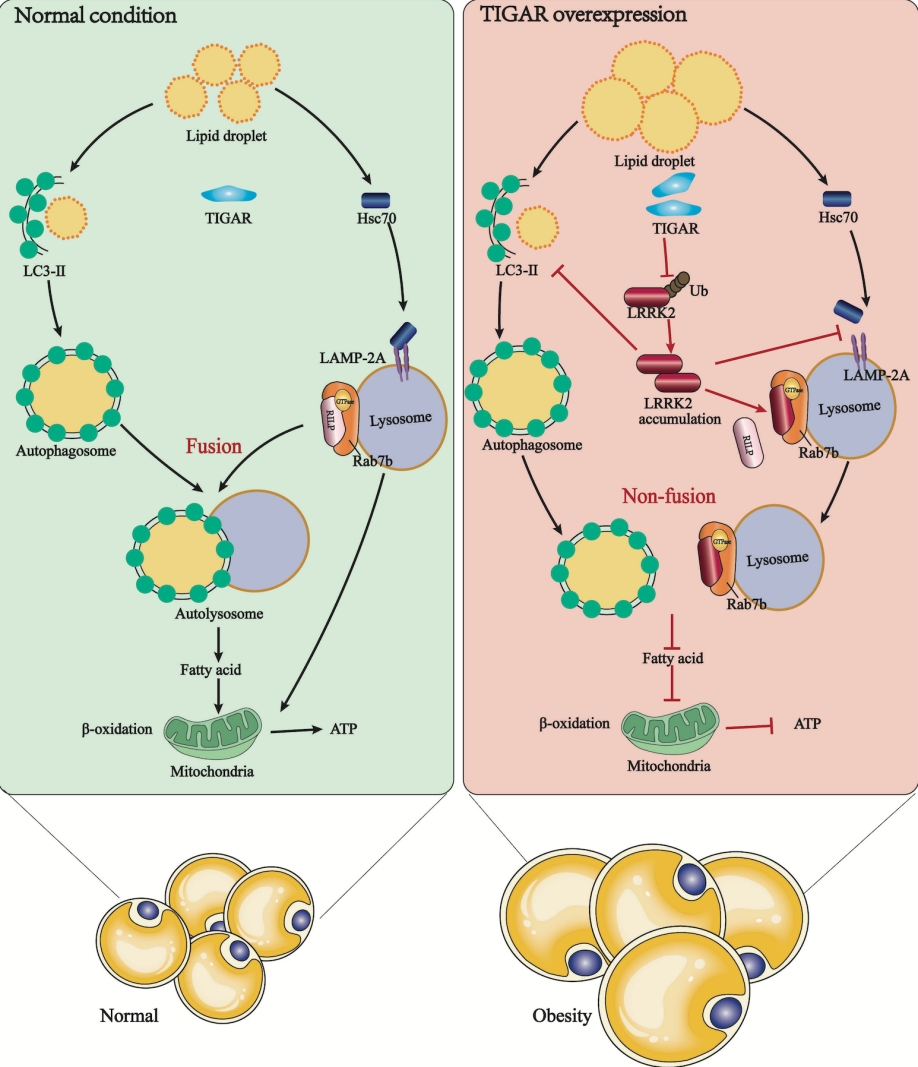
肥胖是全球最常见的代谢性疾病之一,它能增加2型糖尿病、非酒精性脂肪肝和其他心血管疾病的发病率。其主要特征是脂肪细胞中甘油三酯的异常堆积。因此,治疗肥胖症的药物研发一直是医学研究的热点和重点。但是,由于其病因复杂,导致肥胖症的病理机制尚未完全阐明,深入揭示肥胖症的病理新机制和新靶点对于代谢性疾病的防治具有重要意义。自噬(Autophagy)是一种对细胞稳态至关重要的自我降解过程,在脂肪组织的脂质代谢中发挥着重要作用,可以通过脂质动员来维持能量平衡,进而改善肥胖。TIGAR(Trp53诱导的糖酵解调节磷酸酶)已被确认为糖酵解调节因子,它能将糖酵解途径转变为戊糖磷酸旁路,产生大量的NADPH和核糖。目前尚无关于TIGAR在代谢性疾病上的相关报道。
该研究首先从正常饮食喂养的全身性过表达TIGAR转基因小鼠(TG鼠)中观察到明显的肥胖表型,检测到糖脂代谢相关指标出现紊乱。另外,通过非靶向脂质组学检测也发现TG鼠白色脂肪组织中脂质组分明显失调。为了进一步明确其中的分子机制,采用RNA-Seq技术发现在TG鼠白色脂肪组织中Lrrk2和Rab7b基因水平明显上调,同时,研究还发现了TIGAR可以促进富亮氨酸激酶LRRK2和RAB7B相互作用抑制脂肪细胞中脂滴的溶酶体降解。接下来,研究者证实了在3T3-L1脂肪细胞中过表达TIGAR通过抑制LRRK2的泛素-蛋白酶体降解,从而抑制巨自噬和分子伴侣自噬(CMA),最终导致脂质沉积,进而加剧肥胖。另外,本研究还制备了脂肪组织靶向纳米制剂DNL201-NE(DNL201为LRRK2特异性抑制剂),通过尾静脉注射发现DNL201-NE在小鼠脂肪组织中激活了自噬并减轻了小鼠的肥胖。综上所述,该研究表明TIGAR在脂肪细胞中通过富亮氨酸激酶LRRK2抑制巨自噬和CMA,在脂质代谢甚至肥胖中发挥着至关重要的作用。这些研究表明TIGAR有望成为治疗肥胖和代谢相关疾病的关键靶点。
本研究由郭兵教授团队联合苏州大学秦正红教授团队完成。贵州省常见慢性疾病发病机制及药物研究重点实验室、澳门威斯尼斯WNS888入口基础医学院病理生理学教研室张甜副教授为本论文的第一作者,药学院副教授令狐克刚和病理生理学教研室硕士研究生谭佳为本论文的共同第一作者。郭兵教授、秦正红教授、附属医院刘丽荣教授为本论文共同通讯作者。该研究是在国家自然科学青年基金(82100623)、国家自然科学地区基金(32360174)、中国博士后面上项目一等资助(2022M720040)、澳门威斯尼斯WNS888入口青年拔尖人才项目(2022108)、贵州省留学人才择优资助项目(202214)、贵州省科技厅基础研究项目(ZK [2024]113)等项目的支持下完成。
原文链接:https://doi.org/10.1080/15548627.2024.2338576
 公网安备
公网安备